Historia
Su descubrimiento fue realizado casualmente por el físico francés Antoine Henri Becquerel en 1896, quién, observando los efectos de la exposición de materiales fluorescentes y fosforescentes a los rayos X (recientemente descubierto por Wilhelm Roentgenen 1895), para lo cual colocaba un cristal de sulfato de potasio y uranilo, mineral que contiene uranio, encima de una placa fotográfica envuelta en papel negro y las exponía al sol. Cuando desenvolvía la placa la encontraba velada, hecho que atribuía a la fosforescencia del cristal. Los días siguientes no hubo sol y dejó en un cajón la placa envuelta con papel negro y con la sal de Uranio encima. Cuando sacó la placa fotográfica estaba velada, y no podía deberse a la fosforescencia ya que no había sido expuesta a los rayos del sol. La única explicación era que la sal de uranio emitía una radiación muy penetrante. Sin saberlo Becquerel había descubierto lo que Marie Curie llamaría más tarde radiactividad. A pesar de que el descubrimiento fue realizado por este señor, su trabajo en este campo de la física y de la química no fue mucho más allá de eso. Sin embargo, arribaron a estos estudios muchos importantes personajes científicos, y a medida que los estudios daban a luz trascendentes descubrimientos, más y más interesante se hacía este campo.
Poco después de su descubrimiento, el matrimonio conformado por Marie y Pierre Curie tomaron cartas en el asunto, y en los posteriores años se hicieron científicos de gran renombre por su arduo trabajo en la materia; Marie Curie bautizó al fenómeno como radiactividad, además de descubrir otros elementos radiactivos como el torio, el polonio y el radio. A este último le encontraron aplicaciones médicas para el tratamiento de tumores, y fue esta misma mujer quién encabezó una comisión honoraria de radiología durante la guerra. En 1903 fueron galardonados con el premio Nobel de Física junco con Becquerel, por el descubrimiento de la radiactividad natural, siendo Marie, la primera mujer de la historia en recibir tal distinción. Poco después Pierre muere en un accidente, ya muy debilitado por su trabajo con el radio. Marie mientras tanto siguió trabajando y ocupó un muy importante puesto en la Universidad de Sorbona en París, en donde conjuntamente con Ernest Rutherford consiguen demostrar que la radiación que emiten las sustancias radiactivas contienen tres componentes; las partículas alfa, beta y gamma. En 1934, a la edad de 60 años fallece Marie de leucemia, siguiendo su hija; Irene el mismo camino en la investigación que sus progenitores y recibiendo el Nobel junto con su marido por el descubrimiento de la radiactividad artificial.
Pronto se reconoció que la radiactividad era una fuente de energía más potente que cualquiera de las conocidas. Los Curie midieron el calor asociado con la desintegración del radio y establecieron que 1 gramo de radio desprende aproximadamente unos 420 Julios (100 calorías) de energía por hora. Este efecto de calentamiento continua hora tras hora y año tras año, mientras que la combustión completa de 1 gramo de carbón produce un total de 34.000 julios (unas 8.000 calorías) de energía. Tras estos primeros descubrimientos, la radiación atrajo la atención de científicos de todo el mundo.
Núclidos
El término núclido se le asigna a un núcleo con un número específico de neutrones y protones; a los núcleos radiactivos se le denominan radionúclidos y a los átomos con estos núcleos se les llama radioisótopos.
La inmensa mayoría de los núcleos de la naturaleza son estables y permanecen intactos indefinidamente. Sin embargo, los radionúclidos son inestables debido a las inmensas fuerzas de diversa índole que actúan en el núcleo y emiten partículas y radiación electromagnética de manera espontánea. La emisión de radiación es una de las maneras como un núcleo inestable se transforma en uno más estable es decir; con menos energía.
Las clases más comunes de desintegración son como ya fue dicho: la radiación Alfa (α); la Beta (β) y la radiación Gamma (γ).
La desintegración se efectúa cumpliendo ciertas reglas:
- El número de nucleones (A) se debe conservar
- La carga eléctrica se debe conservar
- La energía se debe conservar
- La cantidad de movimiento se debe conservar
- El movimiento angular (incluyendo el movimiento angular Spín) se debe conservar.
Para el caso de la radiación Alfa; se trata de la emisión de un núcleo de Helio, es decir de dos protones y dos neutrones. Para un isótopo emisor de este tipo partículas, esta emisión le significa una disminución en dos unidades de su masa atómica, es decir que pierde dos lugares en la ubicación de la tabla periódica, por otro lado también le significa a ese isótopo la perdida en cuatro unidades de su número másico.
La emisión Beta se trata de electrones de alta velocidad emitidos por un núcleo inestable. Las partículas β se representan en las ecuaciones nucleares por medio del símbolo –1e o -1β. El superíndice 0 indica que la masa del electrón es extremadamente pequeña en relación a la masa del nucleón. El subíndice –1 representa la carga de la partícula. La emisión b equivale a la conversión de un neutrón (0n) en un protón (1p o 1H) la cual aumenta el número atómico en 1.
Las emisiones Gamma o decaimiento gamma son radiaciones electromagnéticas de muy poca longitud de onda. Su emisión está originada por los cambios de energía dentro del núcleo. Su emisión sola; no produce cambios en el número másico o en el número atómico del núcleo.
A veces se producen núcleos en estados excitados por reacciones nucleares y regresan a su estado fundamental por emisión del exceso de energía en forma de radiación:
Ejemplo: [125Te]* 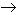 125Te +γ
125Te +γ
Los rayos emitidos por los núcleos específicos tienen un valor específico de energía o conjunto de valores de energía definidos debido a que corresponden a niveles discretos de energía del núcleo. Así; un espectro de emisión de una radiación γ es análoga al espectro de líneas que resultan de la transición de electrones entre los niveles de energía en un átomo excitado.
Tipos de radiación
| PROPIEDAD | α | β | γ |
|---|---|---|---|
| CARGA | 2+ | 1- | 0 |
| MASA | 6.64 x 10-24g | 9.11 x 10-28g | 0 |
| PODER RELATIVO DE PENETRACIÓN | 1 | 100 | 1000 |
| NATURALEZA DE LA RADIACIÓN | NÚCLEOS DE He | ELECTRONES | FOTONES DE ALTA ENERGÍA |
Estabilidad del núcleo
Las fuerzas que existen entre las partículas del núcleo son muy grandes. Las más conocidas de las fuerzas intranucleares es la fuerza de repulsión de Coulomb que los protones experimentan entre sí. Para apreciar la magnitud de esta fuerza de repulsión, comparemos la fuerza entre dos protones cuando estén separados a 10-8 cm, como cuando están en una molécula de Hidrógeno, con la fuerza entre dos protones separados por 10-13cm, como están en un núcleo de Helio. Para el primer caso tenemos:
Donde e es la carga eléctrica de un protón. Para el segundo caso tenemos:
Comparando los dos resultados podemos ver que la fuerza de repulsión entre dos protones en el núcleo es millones de veces mayor que la fuerza entre dos protones de una molécula de hidrógeno. Para sustentar estas enormes repulsiones coulombianas intranucleares y mantener los núcleos unidos, es preciso que existan entre los nucleones fuerzas atractivas muy fuertes. Aunque no se tienen aún muy claras la naturaleza de estas fuerzas y ello constituye uno de los mayores problemas para la física.
Es relativamente fácil resumir la dependencia de la estabilidad nuclear (y por lo tanto de las fuerzas atractivas nucleares) del número de protones y neutrones del núcleo. Para átomos con un número atómico menor a 20, los núcleos son más estables que aquellos con números atómicos de entre 20 y 83, los núcleos más estables tienen más neutrones que protones. Para los átomos con un número atómico mayor que 83, no existe ningún núcleo que se pueda considerar estable en el sentido de nuestra definición.
Las energías asociadas con las reacciones nucleares se pueden examinar con la famosa ecuación de Einstein que relaciona la masa con la energía; E = mc2. En esta ecuación, E representa la energía, m representa la masa y c representa la velocidad de la luz; aprox.3.00. 108m/s. Esta ecuación afirma que la masa y la energía de un cuerpo son directamente proporcionales. Si un cuerpo pierde masa, pierde energía (exotérmica); si gana masa, gana energía (endotérmica). Por ser la constante de proporcionalidad de la ecuación, c2, un número tan grande que incluso pequeños cambios de masa van acompañados de grandes cambios de energía. Los cambios de masa en las reacciones químicas son demasiado pequeñas como para detectarla con facilidad. Por ejemplo; los cambios de masa asociados a la combustión de un mol de CH4 (un proceso exotérmico) es de 9,9 .10-9 g. Debido a que el cambio de masa es tan pequeño, es posible hablar de conservación de la masa en las reacciones químicas.
Los cambios de masa y energía asociados a las reacciones nucleares son mucho mayores que los de las reacciones químicas. Por ejemplo; los cambios de masa que acompañan la desintegración radiactiva de un mol de uranio-238 es muchas veces más grande que la combustión de un mol de CH4. Examinaremos el cambio de energía de esta reacción
238U 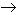 234Th + 4He
234Th + 4He
Los núcleos de esta reacción tienen las siguientes masas: 238U, 238.0003 uma; 234Th, 233.9942 uma He, 4.0015 uma. El Dm se define como la masa total de los productos menos la masa total de los reactivos. El cambio de masa para la desintegración de un mol de uranio-238 se puede expresar por lo tanto en gramos:
233.9942g + 4.0015g – 238.0003g = -0.0046g
El hecho de que en el sistema se ha perdido masa indica que es un proceso exotérmico.
Todas las reacciones nucleares espontáneas son exotérmicas.
El cambio de energía por mol asociado a esta reacción se puede calcular usando las ecuaciones de ecuaciones de Einstein:
ΔE = Δ(mc2) = c2Δm
ΔE = (3,00 .108)2(-0,0046g)(1Kg/1000g) = -4,1 .1011J
Para el cálculo de cambio de masa en una reacción nuclear, por lo general es aceptable el uso de la masa del átomo que contienen los átomos de interés, porque el número de electrones en los productos es ordinariamente el mismo. Por tanto, la diferencia de las masas atómicas es por lo general la misma que la diferencia de masas nucleares.
Durante la década de los 30 los científicos descubrieron que la masa de los núcleos es siempre menor que la suma de la masa de los nucleones individuales de los que se componen. Por ejemplo, el núcleo de He tienen una masa de 4,0015 uma. La masa de un protón es de 1,00867uma. Por consiguiente dos protones y dos neutrones tienen una masa total de Helio-4;
Masa de 2 protones y dos neutrones = 4,03190uma
Masa de un núcleo de He = 4.00150uma
Δm= 0.03040uma
La diferencia de masa entre un núcleo y los nucleones que los constituyen se llaman defecto de masa. El origen del defecto de masa se entiende fácilmente si consideramos que se debe agregar energía a un núcleo para separarlo en protones y neutrones individuales:
E + He 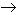 2p + 2n
2p + 2n
La adición de energía a un sistema debe ir acompañada de un aumento proporcional de masa. El cambio de masa para la conversión de He en nucleones individuales es Δm = 0.03040 uma, como se muestra en estos cálculos. La energía que se requiere para este proceso se calcula fácilmente:
ΔE = mc2
ΔE= (3,00 .108m/s)2(0.0304 uma)(1.0g/6.02. 10-23)(1Kg/1000g) = 4.54 . 10-12J
La energía que se requiere para separar el núcleo en nucleones individuales se llama energía de enlace. Cuanto mayor sea la energía de enlace, más estable es el núcleo respecto a su desintegración. Los núcleos de número de masa intermedio están unidos con más fuerza (y son por tanto más estables) que los que tienen números de masa más pequeños o más grandes. Esta tendencia tiene dos consecuencias significativas: en primer lugar, los núcleos pesados ganan estabilidad y por consiguientes desprenden energía si se fragmentan en dos núcleos de tamaño mediano. Este proceso llamado fisión, se usa para generar energía en los reactores nucleares. Segundo, se liberan cantidades aún mayores de energía si los núcleos muy ligeros se combinan o fusionan entre si para dar núcleos de mayor masa. Esta fusión es el proceso fundamental de producción de energía en el sol.
Bibliografía
http://www.textoscientificos.com/fisica/radiactividad
http://www.textoscientificos.com/fisica/radiactividad/estabilidad-nucleo
http://eltamiz.com/2009/09/23/premios-nobel-fisica-1903-antoine-henri-becquerel-maria-sklodowska-curie-y-pierre-curie/


No hay comentarios:
Publicar un comentario